|
UNA HERRAMIENTA NATURAL DE LUCHA CONTRA BRETTANOMYCES EN VINO:
EL QUITOSANO DE ORIGEN FÚNGICO
Nathalie Sieczkowski,1 , Aurelie Bornet,2 Daniel Granes,3 Patricia Taillandier4 y José María Heras1
1Lallemand. 2KitoZyme. 3Institut Coopératif du Vin.4 LGC UMR CNRS 5503 / INP - ENSIACET
Con una práctica y aplicación adecuadas, el quitosano de origen fúngico se ha revelado como una herramienta innovadora para luchar contra Brettanomyces, una amenaza permanente para la calidad de los vinos. Con este estudio se amplían los conocimientos sobre el modo de acción del quitosano y el origen de la inhibición del crecimiento de Brettanomyces en el vino.
Brettanomyces bruxellensis constituye una amenaza permanente para la calidad de los vinos. Estas levaduras de alteración son capaces de desarrollarse en un medio difícil y en cualquier momento de la vida de un vino, particularmente durante la fase de crianza. Actualmente, para luchar contra Brettanomyces se utilizan diferentes medios con mayor o menor éxito, pero no suficientes, pues no existe herramienta totalmente satisfactoria para eliminar estos microorganismos alterantes. Admitido como práctica enológica por el OIV en julio de 2009 y por la Unión Europea en diciembre de 2010, el quitosano de origen fúngico representa una herramienta innovadora y eficaz de lucha contra Brettanomyces. Varios trabajos llevados a cabo en laboratorio mostraban la eficacia del quitosano, y desde el 2008, experiencias en condiciones reales de bodega confirman su efectividad en muy diversas condiciones. Las adquisiciones recientes a partir de los resultados de estas experiencias, abren vías de comprensión del modo de acción del quitosano sobre las células de Brettanomyces.
Las propiedades antibacterianas y antifúngicas del quitosano han sido ampliamente estudiadas y documentadas y hoy son bien reconocidas. Los numerosos estudios demostraban la acción antimicrobiana de este polímero frente a bacterias diversas y patógenos, pero igualmente sobre ciertos hongos de la vid como Botrytis (Barka et al. 2004). Sin embargo, únicamente en un estudio de Gomez-Rivas publicado en 2004, se hacía referencia al interés del quitosano en medios fermentativos y, más particularmente, para la inhibición del crecimiento de Brettanomyces . Es en este contexto en el que una nueva herramienta de lucha contra Brettanomyces ha sido desarrollada: un quitosano de origen fúngico con características específicas para esta aplicación. Esta formulación específica, biodegradable, respetuosa con la salud y no alérgeno, es comercializada bajo la marca NoBrettInside®. Las propiedades y la eficacia de esta herramienta han sido demostradas en condiciones enológicas (laboratorio e industrial) desde 2008 (Blateyron-Pic et al. 2011).
Quitosano de origen fúngico: su modo de acción sobre Brettanomyces reposa en dos efectos
Estudios recientes llevados a cabo en el INP-ENSIACET de Toulouse dirigidos por Patricia Taillandier, tenían como objetivo ampliar el conocimiento sobre el modo de acción del quitosano y el origen de la inhibición del crecimiento de Brettanomyces en el vino.
Se llevaron a cabo experimentaciones sobre medio sintético con el fin de controlar bien la composición (ácido tartárico 3 g/l; glicerina 6 g/l; etanol 13 % v/v; pH 3,7; Brettanomyces 10 6 células/ml). La acción letal del quitosano fue analizada por citometría de flujo en el tiempo posterior a la introducción del quitosano (T 0 , T 5 horas y T 24 horas) en comparación con una modalidad control que no fue sometida a ningún tratamiento. La citometría de flujo permite diferenciar las células muertas y las células vivas. Así como lo demuestra la figura 1, en medio sintético, la acción letal del quitosano frente a Brettanomyces es rápida. A la dosis de 4 g/hl, cinco horas bastan para ver un efecto letal sobre el 60 % de la población de Brettanomyces presente en el medio sintético. Por otra parte, se ha comprobado que el tiempo de contacto mínimo para tener una eficacia satisfactoria del quitosano a 4 g/hl en el vino es de 10 días (véase aplicación).
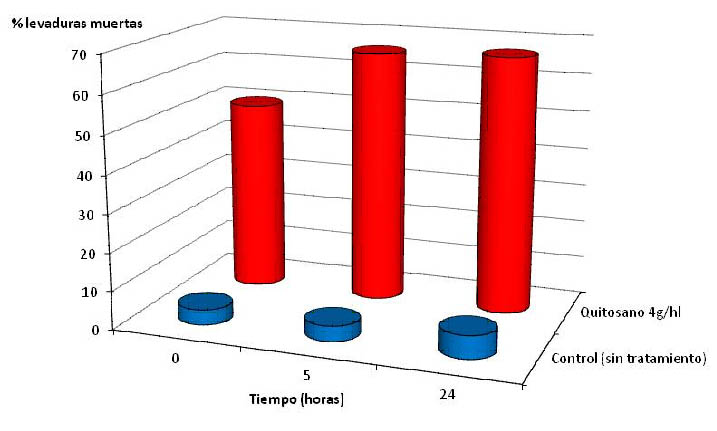
Figura 1. Seguimiento por citometría de flujo de la evolución de la mortalidad de Brettanomyces en el tiempo estudiado.
Este estudio permitió también demostrar que el quitosano tenía igualmente un efecto biológico frente a Brettanomyces. En este sentido se realizaron medidas de flujo de ATP intracelular durante las 2 horas comparando una modalidad control (ausencia de quitosano en el medio sintético + Brettanomyces 18 x 10 6 células / ml) y una modalidad tratamiento (presencia de quitosano a la dosis de 10 g/hl en el medio sintético + Brettanomyces 18 x 106 células/ml). Podemos observar en la figura 2 que la presencia de quitosano genera una liberación del ATP en el medio. Este fenómeno se traduce una perturbación fuerte de la permeabilidad de la membrana de Brettanomyces muy probablemente correlacionada a la mortalidad de Brettanomyces observada (figura 2).
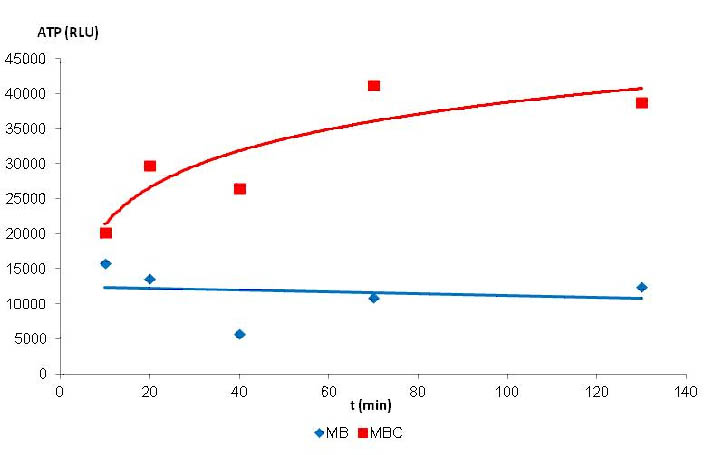
Figura 2. Seguimiento de la evolución del flujo de ATP de Brettanomyces en el tiempo en presencia de quitosano 10 g/hl (rojo) y sin quitosano (azul).
Durante este trabajo, se demostró igualmente el efecto físico que el quitosano tenía frente a las células de Brettanomyces. Como muestran las fotos de observación de microscopia clásica (foto 1A) y de microscopia electrónica (foto 1B), el quitosano y Brettanomyces se agregan, gracias muy probablemente, a interacciones de carga, lo que provoca la sedimentación de las células de Brettanomyces. En efecto, al pH en el que se realizaron los estudios, pH del vino, el quitosano está cargado positivamente, mientras que la superficie de la levadura Brettanomyces está cargada negativamente.
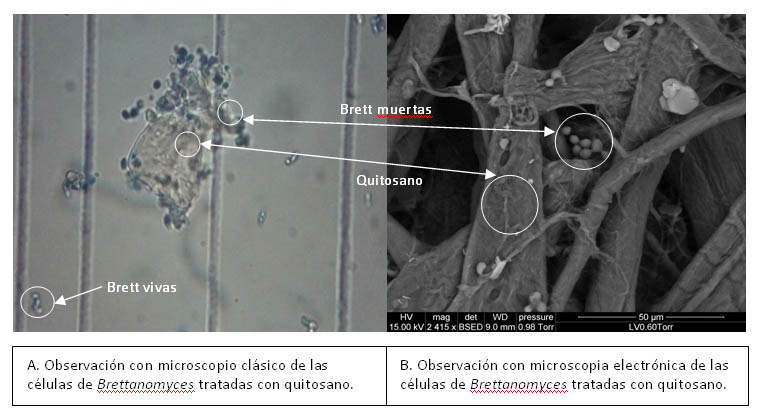
Foto 1. Observación de Brettanomyces tratados con quitosano.
En conclusión, este estudio permitió demostrar así que el quitosano tenía dos efectos complementarios frente a las células de Brettanomyces presentes en los vinos:
• Un efecto biológico: Interacción entre el quitosano y la membrana de Brettanomyces que provoca una pérdida de la viabilidad de estas últimas.
• Un efecto físico: Interacción de carga entre el quitosano y la pared de Brettanomyces que provoca la agregación y la sedimentación de Brettanomyces.
El quitosano de origen fúngico: los resultados probados en experiencias en bodegas En referencia a la aplicación en condiciones de bodega, se ha contrastado la eficacia del tratamiento gracias a las numerosas experiencias en diferentes matrices de vino, variedades y zonas vitivinícolas del mundo. Una parte importante de estos resultados, se han obtenidos en aplicaciones realizadas en bodegas de diferentes zonas de España. Algunos de estos resultados se agrupan en la figura 3, en los que se sigue la evolución de las poblaciones de Brettanomyces después de un tratamiento de 10 días de quitosano a la dosis 4 g/hl seguido por un trasiego. Estas medidas se realizaron 10 días después del trasiego y a los 3 meses del trasiego. En estas condiciones industriales donde las recomendaciones de aplicación del quitosano de origen fúngico han sido bien seguidas, la eficacia del tratamiento se demuestra sobre niveles de población que pueden alcanzar niveles superiores a 10 4 UFC/ml.
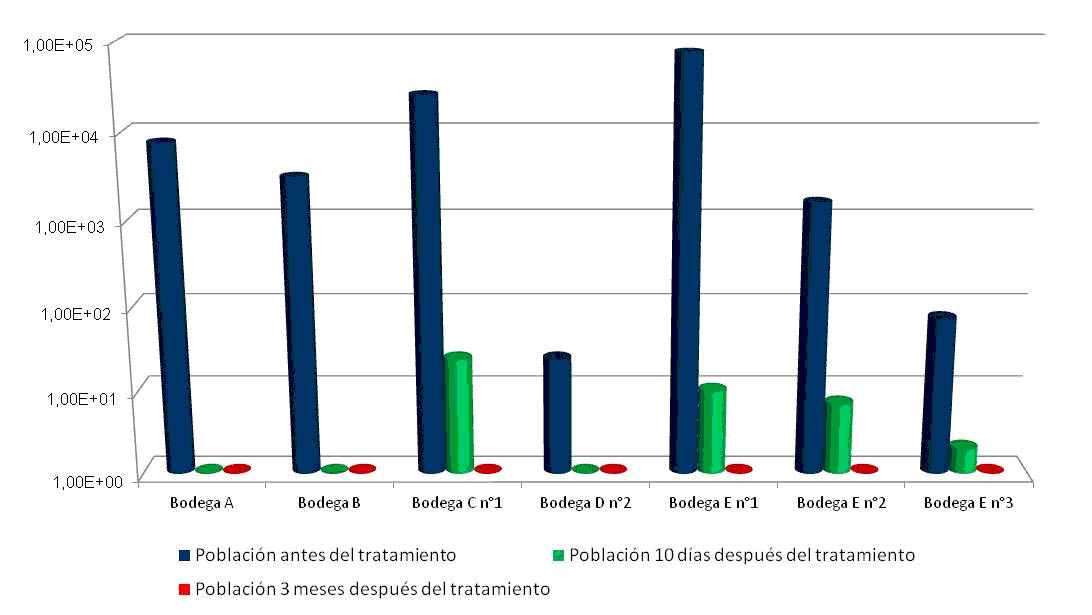
Figura 3. Resultados de experiencias en bodegas tras un tratamiento de 10 días de quitosano a dosis 4 g/hl. Población de Brettanomyces (UFC/ml), RT-PCR.
En estas experiencias, se analizaron los niveles de fenoles volátiles en los tres momentos indicados anteriormente (antes de tratamiento, 10 días y tres meses después del mismo). No se observaron aumentos de los niveles de 4-etilfenol y 4-etilguayacol por parte de las células afectadas por el tratamiento, hecho que va en la línea de los datos presentados sobre el efecto letal en corto espacio de tiempo.
Por otra parte, se realizaron controles analíticos de otros parámetros enológicos, donde se comprobó la no incidencia de los tratamientos a nivel de la acidez del vino, pH, acidez volátil, color ó polifenoles totales. Desde el punto de vista sensorial, no se perciben cambios desde el punto de vista aromático y la calidad gustativa del vino.
A notar que en el caso del análisis de las poblaciones residuales por PCR cuantitativo, se puso en evidencia algunos resultados de falsos positivos a la cuantificación de DNA presente en células muertas o en estado subletal si un cierto plazo postrasiego no es respetado (por lo menos 20 días).
Conclusiones El quitosano de origen fúngico respetando las recomendaciones de puesta en ejecución es una herramienta que innova para luchar contra Brettanomyces.
La eficacia del quitosano observada en experiencias sobre diferentes tipos de vinos tintos y en varias regiones, ha sido confirmada por experiencias en laboratorio sobre matriz sintética. Estos últimos estudios permitieron demostrar que el quitosano tiene un efecto doble: biológico y físico sobre las células de Brettanomyces. Los mecanismos implicados parecen estar ligados a pérdidas de integridad de membrana, como se ha demostrado para otro tipo de microorganismos.
Desde el punto de vista de la aplicación, se deben realizar ciertas prácticas con el fin de asegurar una eficacia completa del quitosano. El quitosano es insoluble, por lo que es necesario ponerlo en suspensión en agua o en vino, antes de incorporarlo de manera homogénea al vino. Después de haber introducido la suspensión de quitosano en el vino por la parte superior del depósito, hay que efectuar un remontado de homogeneización correspondiente al volumen de la cuba. El quitosano debe ser eliminado posteriormente con las lías en el momento del trasiego efectuado 10 días después del tratamiento.
Bibliografía
Blateyron-Pic L. et al. (2012). Le chitosane d'origine fongique : un outil de choix pour lutter contre Brettanomyces dans les vins. Revue des oenologues 143: 27-28.
Chung, Y. C.; Su, Y.P.; Chen, C.C.; Jia, G.; Wang, H.L.; Wu, J.C.G.; Lin, J.G. (2004). Relationship between antibacterial activity of chitosan and surface characteristics of cell wall. Acta Pharmacol Sinica 25 (7): 932-936.
Coma V. ; Deschamps, A.; Martial-Gros, A. (2003). Bioactive Packaging Materials from Edible Chitosan Polymer—Antimicrobial Activity Assessment on Dairy-Related Contaminants. J Food Sci 68: 2788-2792.
Gomez-Rivas, L.; Escudero-Abarca, B. I.; Aguilar-Uscanga, M. G.; Hayward-Jones, P. M.; Mendoza, P.; Ramírez, M. (2004). Selective antimicrobial action of chitosan against spoilage yeasts in mixed culture fermentations. J Ind Microbiol Biotechnol 31:16-22.
Kong, M.; Guang Chen , X.; Park, H.J. (2010) Antimicrobial properties of chitosan and mode of action: a state of the art review. Int J Food Microbiol 144: 51-63.
Kurita, K. (2006) Chitin and Chitosan: Functional Biopolymers from Marine Crustaceans. MarBiotechnol 8 (3) : 203-226.
Liu, X.F.; Guan, Y.L.; Yang, D.Z.; Li, Z.; Yao , K.D. (2001) Antibacterial action of chitosan and carboxymethylated chitosan. J Appli Polym Sci 79 (7): 1324.
Loureiro, V.; Malfeito-Ferreira, M. (2006). Dekkera/Brettanomyces spp. Chapter 13. En: Blackburn, C. de W. (ed). Food spoilage microorganism. Abington, Cambridge, UK: Woodhead Publishing Ltd.: 353-398.
No, H. Park, N. Y.; Lee, S. H.; Meyers, S. P. (2002) Antibacterial activity of chitosans and chitosan oligomers with different molecular weights. Int J Food Microbiol 74: 65-72.
Omura, Y. Shigemoto, M., Akiyama, T., Saimoto, H., Shigemasa, Y., Nakamura, I.; Tsuchido, T. (2003). Antimicrobial Activity of Chitosan with Different Degrees of Acetylation and Molecular Weights. 8 : 25-30.
Pic, L. ; Granes, D. ; Sieczkowski, N.; Bornet, A. (2011). Chitosane : un nouvel outil pour lutter contre Brettanomyces et préserver les qualités aromatiques des vins Le XXIVème Congrès International de la Vigne et du Vin, 20-27 juin, Porto, Portugal.
Rabea, E.I.; Badawy, M.E.I.; Stevens, C.V.; Smagghe, G.; Steurbaut, W. (2003). Chitosan as antimicrobial agent: applications and mode of action. Biomacromolecules 4 (6): 1457-1465.
Rhoades, J.; Roller, S. (2000). Antimicrobial actions of degraded and a native chitosan against spoilage organisms in laboratory media and foods. Appl Environ Microbiol 66: 80-86.
Shahidi, F.; Arachchi, J. K. V.; and Jeon, Y. J. (1999). Food applications of chitin and chitosans Trends Food Sci Technol 10 (2): 37-51.
Sudarshan, N.R.; Hoover , D. G. and Knorr, D. (1992). Antimicrobial action of chitosan. Food biotechnology 6 (3): 257-272.
(Abril 2013)
|